Souhrn
Výzkumníci vyvinuli model Cryo-IEF, základní model umělé inteligence určený pro zpracování dat z kryogenní elektronové mikroskopie (cryo-EM). Model byl předtrénován na 65 milionech obrazů částic v nekontrolovaném učení, což mu umožňuje automatizovat složité kroky určení 3D struktur biomolekul. Tím se cryo-EM stává robustnější a dostupnější pro laboratoře bez specializovaného know-how.
Klíčové body
- Předtrénování na 65 milionech particle images z cryo-EM dat v unsupervised módu.
- Automatizace celého workflow od hodnocení obrazů po rekonstrukci struktur.
- Inspirace self-supervised vision transformers a metodami jako CryoDRGN-AI.
- Publikováno v Nature Methods s odkazy na EMPIAR databázi.
- Otevřený přístup k modelu pro široké využití v strukturální biologii.
Podrobnosti
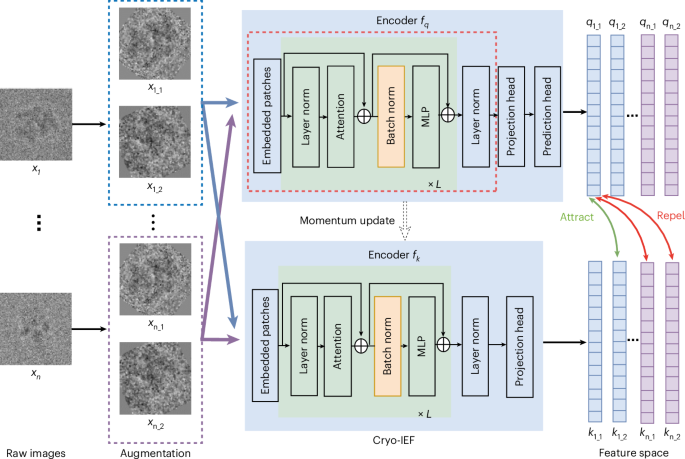
Kryogenní elektronová mikroskopie (cryo-EM) je klíčovou technikou v strukturální biologii, která umožňuje rekonstruovat trojrozměrné struktury proteinů a komplexů bez nutnosti krystalizace. Proces zahrnuje sběr tisíců obrazů zamrazených vzorků, identifikaci částic (particle picking), jejich klasifikaci, 2D/3D rekonstrukci a rafinaci. Tyto kroky jsou časově náročné a vyžadují expertizu, což omezuje šíření metody.
Model Cryo-IEF řeší tyto problémy pomocí foundation model přístupu, podobného velkým jazykovým modelům, ale zaměřeného na obrazy. Předtrénování proběhlo na masivním datasetu 65 milionů particle images z veřejné databáze EMPIAR, která shromažďuje cryo-EM a cryo-ET data. Použití unsupervised učení, inspirovaného pracemi jako self-supervised vision transformers od Chen et al. (2021), umožnilo modelu naučit se reprezentace bez označených dat. Výsledek je univerzální enkóder, který exceluje v úkolech jako hodnocení kvality obrazů, particle picking, klasifikace heterogenity a ab initio rekonstrukce.
Například v porovnání s předchozími metodami jako CryoDRGN-AI (Levy et al., 2025) Cryo-IEF zlepšuje zpracování náročných datasetů s vysokou heterogenitou. Model lze doladit (fine-tune) pro specifické úkoly, což snižuje potřebu manuálních zásahů. Autoři demonstrují aplikace na reálných datech, včetně těch z Nogalesovy recenze (2016) o vývoji cryo-EM do mainstream techniky. Přístup k plnému textu vyžaduje předplatné Nature Portfolio nebo jednorázový nákup za 39,95 USD, což odráží akademický charakter publikace.
Proč je to důležité
Tento vývoj posiluje integraci AI do experimentální biologie, kde cryo-EM revolucionizovala objevování léků – například struktury spike proteinu SARS-CoV-2. Automatizace workflow urychlí výzkum o desítky procent, sníží chyby a umožní menším týmům konkurovat velkým laboratořím. V širším kontextu ukazuje, jak foundation models migruje z obecného AI do specializovaných domén, podobně jako v medicínském zobrazování. Nicméně závislost na kvalitních datech z EMPIAR znamená, že úspěch závisí na dostupnosti tréninkových sad; bez dalšího škálování může být omezen na standardní případy. Pro průmysl, jako farmaceutické firmy, to znamená rychlejší screening molekul, ale vyžaduje validaci na proprietárních datech.
Zdroj: 📰 Nature.com
 |
|  | flashlights, headlamps Fenix & outdoor | Vybavení do přírody | Brandýs nad Labem-Stará Boleslav | Letní škola AI
| flashlights, headlamps Fenix & outdoor | Vybavení do přírody | Brandýs nad Labem-Stará Boleslav | Letní škola AI